教你如何利用外顯子體定序發表高分SCI文章
雖然一項科研成果不能僅用一篇或幾篇SCI文章來評價,但發表高水平的SCI文章確實在一定程度上反映了研究人員的研究能力。在眾多定序方法中,外顯子體定序技術是比較常見且發表文章數量比較多的一種,今天,小編就來談談利用外顯子體定序發表的文章。在此之前,我們先來了解一下什麼是外顯子體定序吧!
1. 直接對蛋白編碼序列進行定序,找出影響蛋白結構的變異;
2. 高深度定序,可發現常見變異及頻率低於1%的罕見變異;
3. 外顯子約占基因體的1%,有效降低費用、週期和工作量。
下面小編為大家解析兩篇應用外顯子體定序方法進行研究的文章,案例一是在Nature Genetics上發表的有關先天性心臟病的文章,探討了基因在心臟病研究中發揮的作用;案例二是在American Journal of Human Genetics上發表的文章,首次發現了人類無頭精子症的致病基因,這兩篇文章各具特色。
透過WES定序識別綜合徵型先天性心臟病和非綜合徵型先天性心臟病不同的遺傳結構[1]
期刊:Nature Genetics 時間:2016.08 IF:31.616
1)研究背景
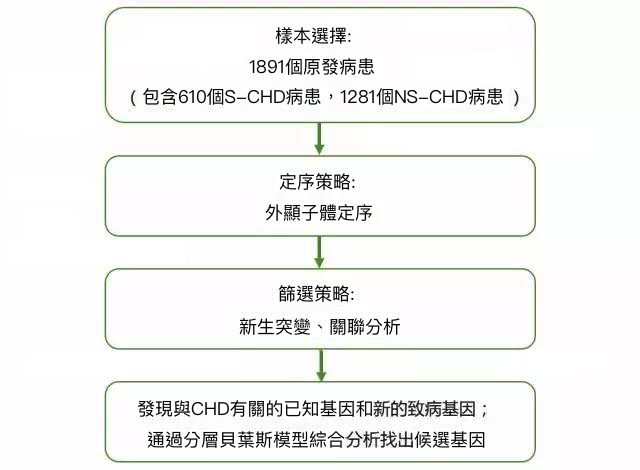
先天性心臟病(Congenital heart defects,CHDs)在新生兒中的的發病率在0.8~1%,儘管CHD在人類中有大量單基因病的例子,但是患者的兄弟姐妹患此病的風險卻很低,顯示新生突變或不完全外顯發揮重要作用。有CHD症狀的綜合徵病人中的10%有新生的蛋白結構截斷變異(PTVs),該研究用WES的方法檢測了1,891個原發患者,包括610個綜合徵型CHD(S-CHD)患者和1281個非綜合徵型CHD(NS-CHD)患者。在已知的CHD相關基因中,對於S-CHD,確定了新生PTVs是不可遺傳的;相反的,在NS-CHD患者中發現,PTVs是可遺傳的並遺傳自未患病的父母。隨後,識別了在CHD4、CDK13和PRKD1上的新生突變與S-CHD顯著相關,該研究為S-CHD和NS-CHD患者的兄弟姐妹有低患病的風險提供了遺傳證據。
3)研究結果
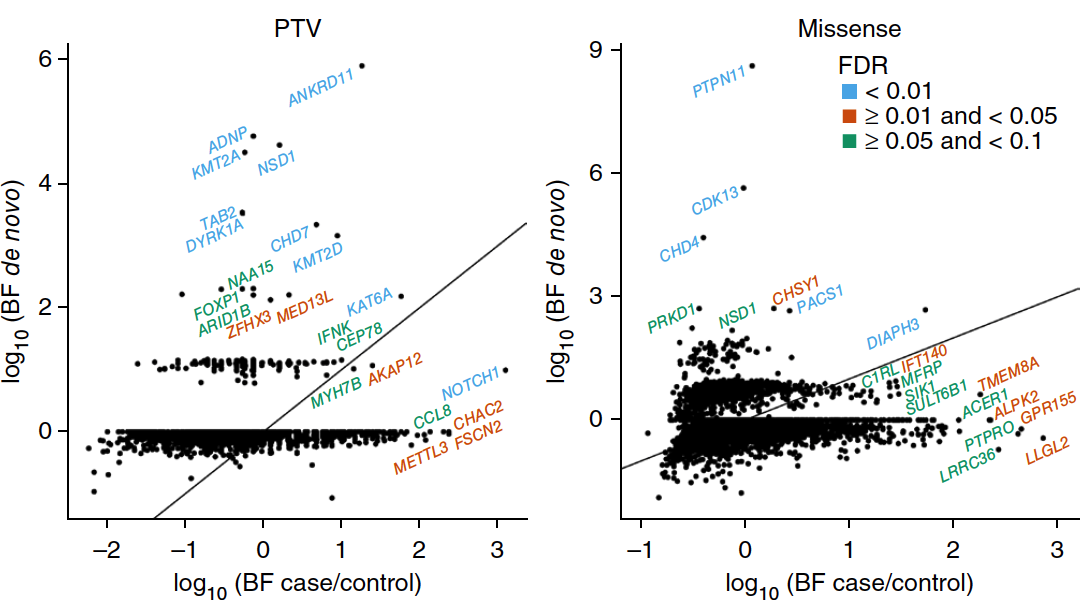
I. S-CHD和NS-CHD相比,新生PTV和錯義突變的數量顯著增多。
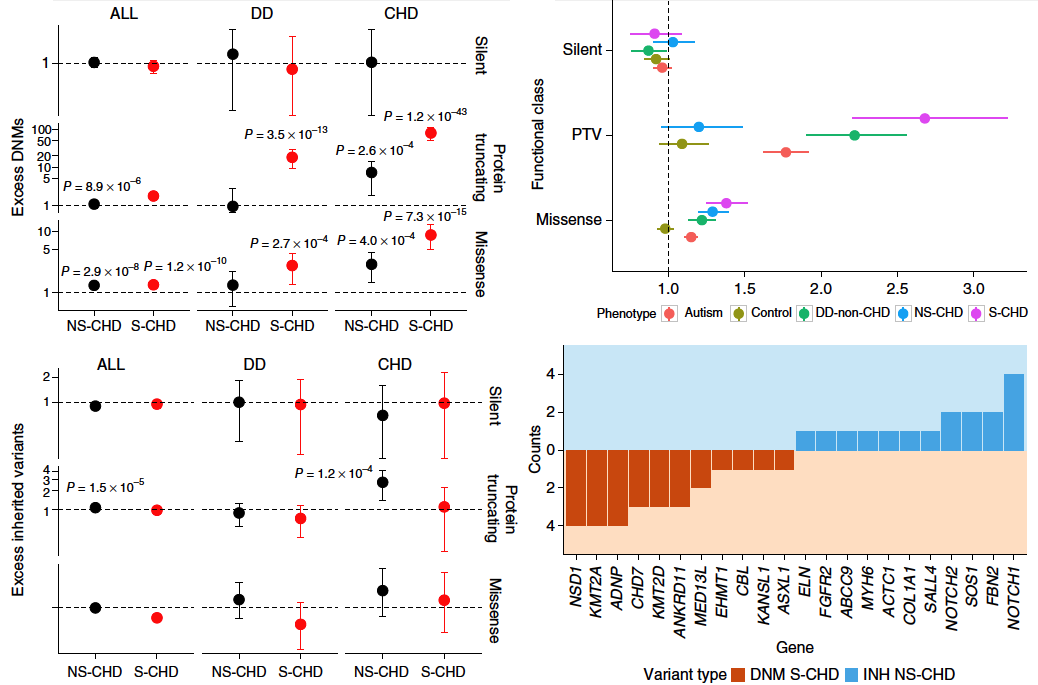
圖1. 通過Burdern分析,在S-CHD和NS-CHD患者中比較新生突變和遺傳突變
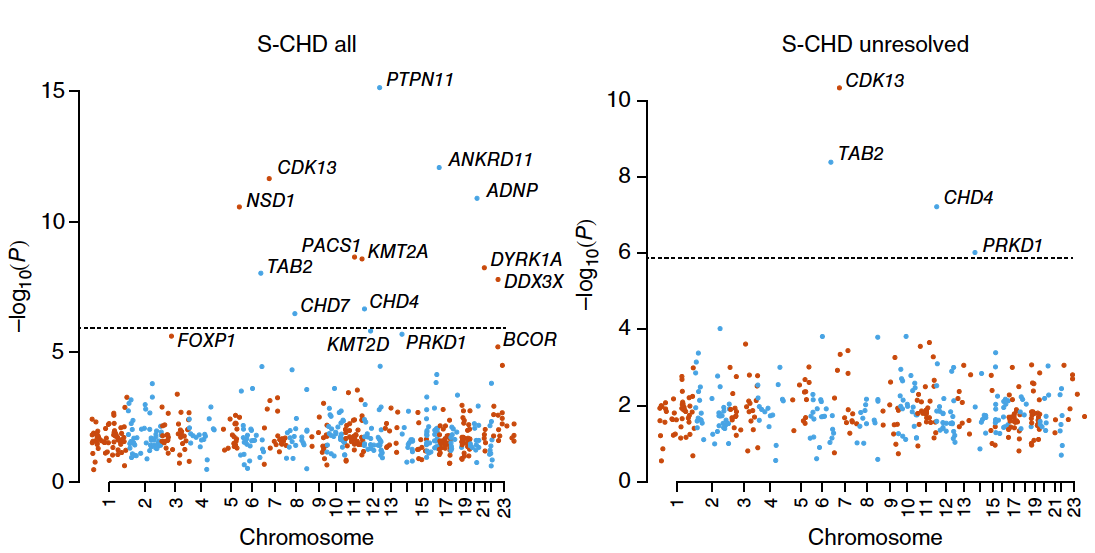
II.在S-CHD患者中富集的有顯著性差異的新生突變的基因中,9個與發育障礙相關,8個與CHD相關。
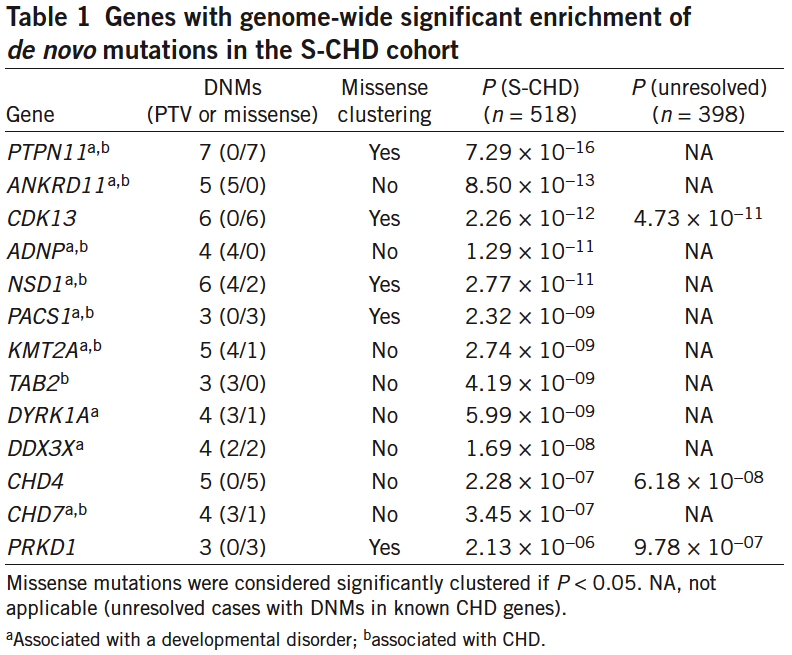
表1. 在S-CHD患者中富集到的有顯著性差異的新生突變的基因
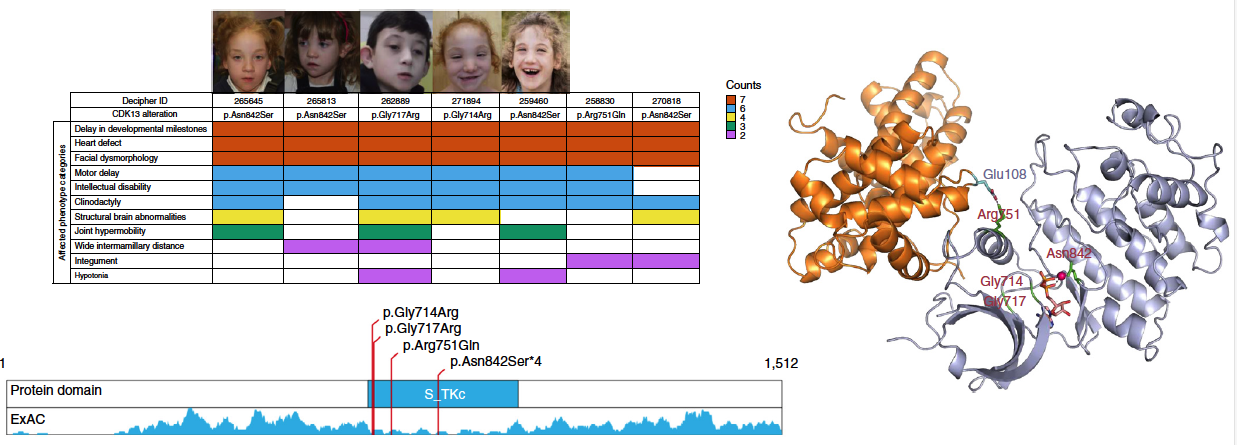
III. 發現了3個S-CHD的新的致病基因,分別為CDK13 , CHD4和PRKD1;其中CDK13編碼的蛋白高度保守。
圖3. 在S-CHD患者中的CDK13突變
IV.通過分層貝葉斯模型綜合分析,發現16個基因有很高的可信度,12個與發育障礙相關,1個與CHD相關與發育障礙無關(MYH6),3個(CHD4,CDK13和DIAPH3)是之前未知的候選基因。
4)研究結論
I. S-CHD患者的致病機制是因為發生了新生PTVs;NS-CHD患者的致病機制則是因為PTVs遺傳自未患病的父母,遺傳模式為不完全外顯。
II.為解釋CHD患者的兄弟姐妹有低的患病風險提供了遺傳依據。
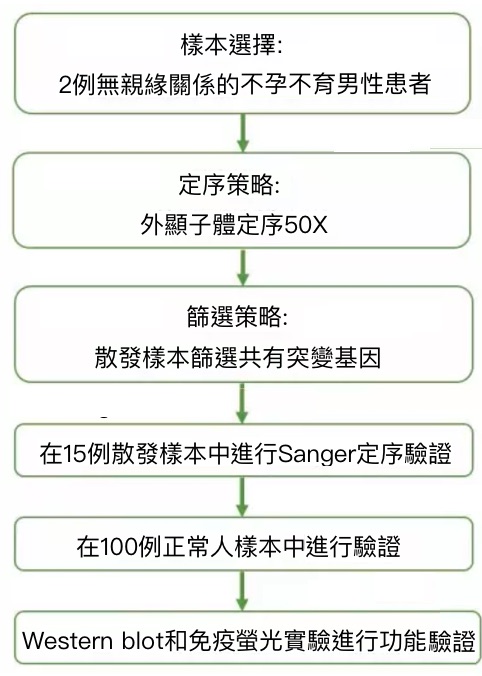
以上就是利用1,891個樣本發表的一篇不錯的文章,然而,大家不禁會問,如果沒有大樣本量就不能發好文章了嗎?別急,下面小編就為您奉上一篇小樣本量(前期只用了2例樣本)且用外顯子體定序方法發表的文章。
SUN5雙等位基因突變導致常染色體隱性無頭精子綜合徵[2]
期刊:American Journal of Human Genetics
時間:2016.09 IF:10.794
1)研究背景
目前將近15%的夫妻面臨不孕不育症所帶來的痛苦,其中50%是由男方因素所致,而導致男性不育的主要原因之一是畸形精子症。自1981年第一個人類無頭精子症病例報導以來,國際上陸續報導了20多個無頭精子症病例,但仍未發現任何基因的突變與人類該表型相關。此綜合徵患者的精液中接近100%的精子都畸形。此綜合徵在家系和近親結婚家系中出現,有強烈的遺傳起源。本研究透過外顯子體定序,在2例散發無親緣關係的不孕不育男性患者中發現SUN5基因突變:a.一個存在純合突變(c.824C>T[p.Thr275Met]);b .另一個存在復合雜合突變(c.1006C>T [p.Arg356Cys]和(c.485T>A[p.Met162Lys])。透過不同的驗證方法得出結論:SUN5基因突變是導致人類無頭精子症的主要致病原因。
3)研究結果
I.針對2例散發樣本篩選共有突變基因,發現SUN5基因發生突變:a.一個樣本中存在純合突變(c.824C>T[p.Thr275Met]);b.另一個樣本中存在復合雜合突變(c.1006C>T [p.Arg356Cys]和( c.485T>A[p.Met162Lys]);
II. SUN5上攜帶的突變在8/17無親緣關係的不孕不育男性樣本中存在,解釋了47.06%的患者;
III.突變導致SUN5表現缺失、表現量顯著降低、截斷表現,某些突變導致SUN5在精子頭—尾連接處分佈改變。
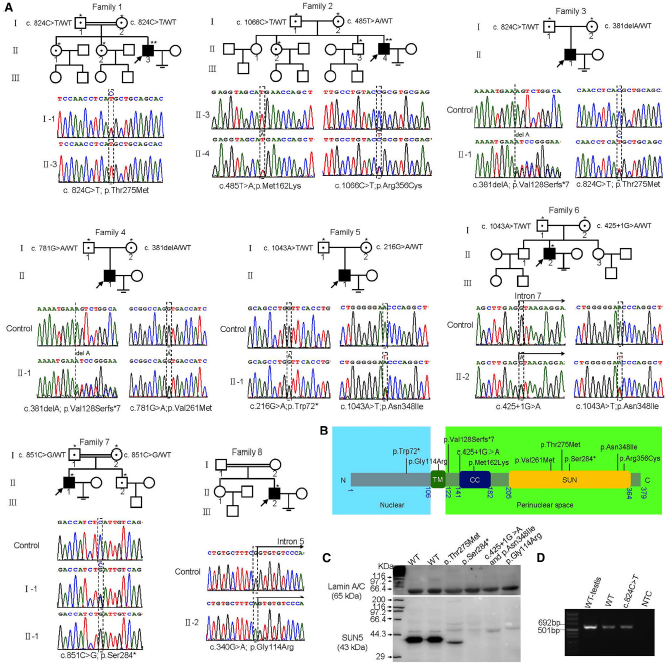
圖5. 家系圖譜和無頭精子綜合徵家系中SUN5基因突變(Sanger定序)
4)研究結論
I.該研究結果揭示了SUN5雙等位基因突變引起常染色體—隱性無頭精子綜合徵,並且是導致人類無頭精子症的主要致病原因。
II. SUN5基因是首個被發現的參與人類無頭精子症發病分子機制的基因。
III. 該研究成果為人類無頭精子症的精確診斷、遺傳諮詢以及生育選擇提供了理論依據。
參考文獻
[1] Sifrim A, Hitz MP, Wilsdon A, et al . Distinct genetic architectures for syndromic and nonsyndromic congenital heart defects identified by exome sequencing[J]. Nat Genet , 2016,48(9):1060-1065.
[2] Zhu F, Wang F, Yang X, et al . Biallelic SUN5 Mutations Cause Autosomal-Recessive Acephalic Spermatozoa Syndrome[J]. Am J HumGenet , 2016, 99(4):942-949.
圖爾思生物科技 / 諾禾致源文案