11
2025.09
告別檢體限制!10x Flex 單細胞定序如何加速糖尿病免疫異常研究進程
在複雜的臨床研究中,早期需要活細胞上機的單細胞實驗往往受限於病人篩選與檢體收集的時間要求,導致單細胞定序檢體數量難以有效提升。然而,10x Single Cell Gene Expression Flex 技術的問世,透過其獨特的固定細胞儲存檢體優勢,能大幅降低臨床研究中檢體收集的門檻,顯著提升實驗的靈活性。這項技術不僅導入探針雜交反應以提升基因偵測的靈敏度,更允許一次最多混合 16 個樣本進行上機,進而大幅降低單一樣本的上機成本,為多樣本單細胞定序提供了理想解決方案。接下來,我們將深入分享一篇利用 10x Flex 的多樣本臨床研究,解開糖尿病患者免疫異常謎團的相關文獻。
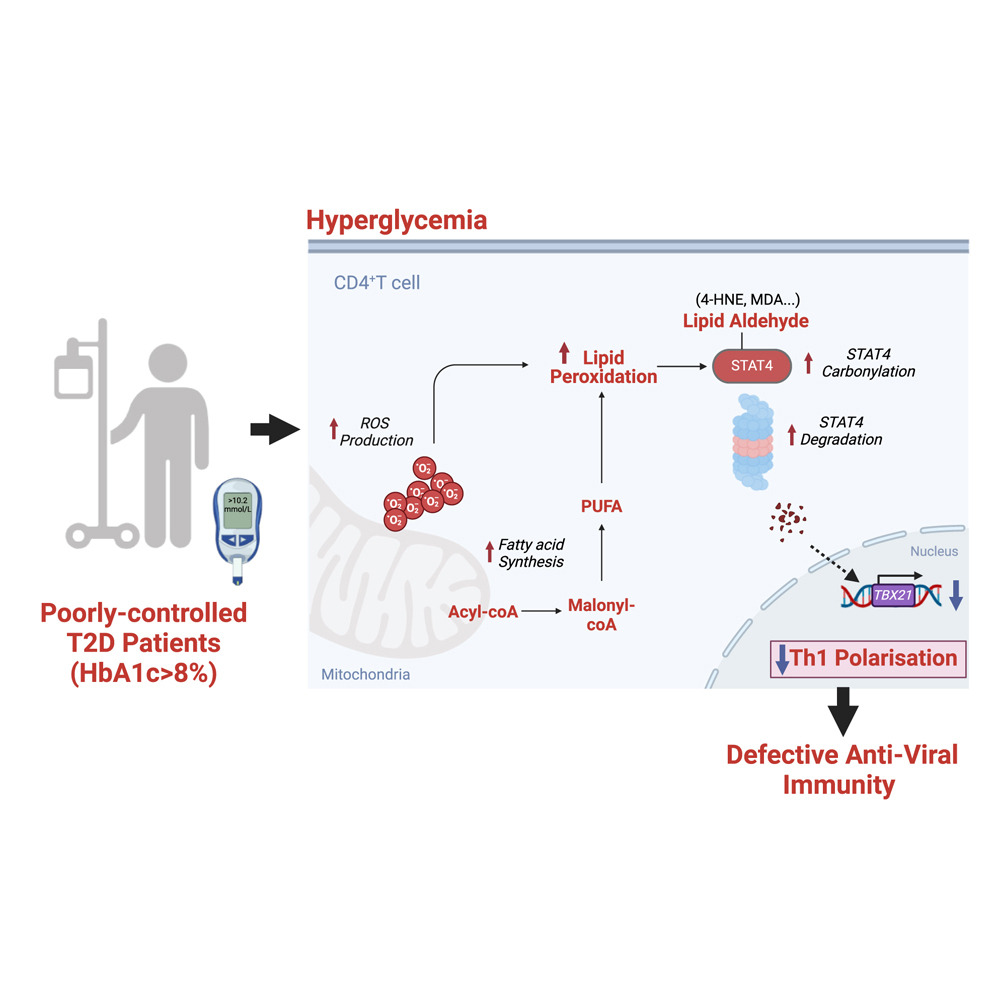
過去研究曾指出,第二型糖尿病 (Type 2 Diabetes, T2D) 患者較容易罹患嚴重的呼吸道病毒感染(如 COVID-19 和 流感),但其確切的免疫異常機制仍不明確。本篇重要文獻透過分析感染 COVID-19 的 T2D 患者血液樣本,以及感染流感病毒的小鼠模型,取得重大突破:研究發現高血糖 (hyperglycemia) 會誘發粒線體功能障礙,進而促進脂肪酸合成,導致 CD4+ T 細胞內氧化壓力增加與異常脂質累積。這種異常的脂質累積會引發脂質過氧化 (lipid peroxidation, LPO),進一步導致 STAT4 的碳基化 (carbonylation)。值得注意的是,STAT4 是輔助T細胞 (Th1) 分化的關鍵調控因子,但碳基化後的 STAT4 會迅速降解,導致轉錄因子 T-bet/TBX21 表達下降,最終削弱 Th1 反應。由於 Th1 反應在抗病毒免疫中扮演關鍵作用,這項機制或許能直接說明 T2D 患者更容易受到病毒感染的原因。
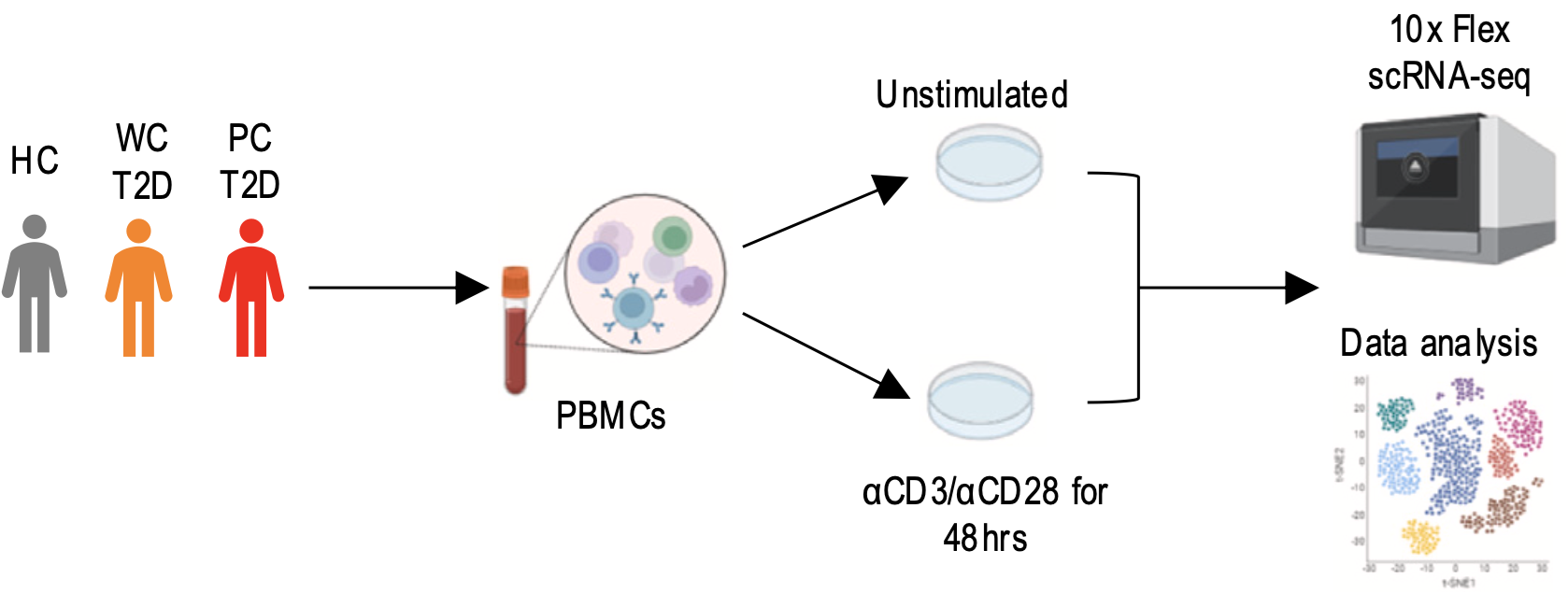
本篇文獻的精華在於,它透過單細胞定序和偽時間分析 (pseudotime analysis),比較健康對照組 (HC) 與兩類 T2D 患者(血糖控制良好 (WC-T2D) 和血糖控制不佳 (PC-T2D))的代謝變化。研究團隊將 HC 及 T2D 患者血液中分離出的 PBMC 樣本單細胞定序,並深入分析 CD4+ T 細胞在 anti-CD3/anti-CD28 刺激前後,從初始 (naïve) 狀態轉變為活化狀態時的轉錄變化。根據差異表達基因 (DEGs)、典型免疫標記 (immune markers) 及基因特徵 (curated gene signatures),研究人員將 CD4+ T 細胞區分為四種轉錄狀態:初始細胞 (Tn)、早期活化細胞 (Tearly_act)、活化細胞 (Tact) 及增殖細胞 (Tprolif)。偽時間分析結果進一步確認,CD4+ T 細胞的分化路徑符合預期,即 Tn → Tearly_act → Tact → Tprolif。分析結果還顯示,PC-T2D 患者的 CD4+ T 細胞在活化過程中表現出顯著的代謝異常,包括脂質合成 (lipid anabolism) 相關基因上調,脂質分解 (lipid catabolism)、粒線體功能與細胞氧化還原平衡 (redox homeostasis) 相關基因下調,精準描繪了糖尿病免疫失衡的細胞代謝再程式化 (reprogramming)。
本篇文獻共收集 57 份人類樣本,其中包括健康對照組 (HC) 17 人、WC-T2D 患者 17 人及PC-T2D 患者 23 人。透過 單細胞定序,研究成功捕捉到 HC 與 T2D 患者 CD4+ T 細胞在活化過程中的代謝變化。此文獻作為多樣本臨床研究的典範,充分展現了 10x Single Cell Gene Expression Flex 在檢體儲存與混合樣本上機方面的卓越優勢,為未來糖尿病免疫研究提供了強大的工具與新的視角。
立即了解圖爾思專業服務>> 10x Genomics Single Cell Gene Expression Flex 單細胞定序服務
資料來源
Hyperglycemia-triggered lipid peroxidation destabilizes STAT4 and impairs anti-viral Th1 responses in type 2 diabetes
Cell Metab . 2024 Dec 3;36(12):2511-2527.e7. doi: 10.1016/j.cmet.2024.10.004.
回上一頁

過去研究曾指出,第二型糖尿病 (Type 2 Diabetes, T2D) 患者較容易罹患嚴重的呼吸道病毒感染(如 COVID-19 和 流感),但其確切的免疫異常機制仍不明確。本篇重要文獻透過分析感染 COVID-19 的 T2D 患者血液樣本,以及感染流感病毒的小鼠模型,取得重大突破:研究發現高血糖 (hyperglycemia) 會誘發粒線體功能障礙,進而促進脂肪酸合成,導致 CD4+ T 細胞內氧化壓力增加與異常脂質累積。這種異常的脂質累積會引發脂質過氧化 (lipid peroxidation, LPO),進一步導致 STAT4 的碳基化 (carbonylation)。值得注意的是,STAT4 是輔助T細胞 (Th1) 分化的關鍵調控因子,但碳基化後的 STAT4 會迅速降解,導致轉錄因子 T-bet/TBX21 表達下降,最終削弱 Th1 反應。由於 Th1 反應在抗病毒免疫中扮演關鍵作用,這項機制或許能直接說明 T2D 患者更容易受到病毒感染的原因。

本篇文獻的精華在於,它透過單細胞定序和偽時間分析 (pseudotime analysis),比較健康對照組 (HC) 與兩類 T2D 患者(血糖控制良好 (WC-T2D) 和血糖控制不佳 (PC-T2D))的代謝變化。研究團隊將 HC 及 T2D 患者血液中分離出的 PBMC 樣本單細胞定序,並深入分析 CD4+ T 細胞在 anti-CD3/anti-CD28 刺激前後,從初始 (naïve) 狀態轉變為活化狀態時的轉錄變化。根據差異表達基因 (DEGs)、典型免疫標記 (immune markers) 及基因特徵 (curated gene signatures),研究人員將 CD4+ T 細胞區分為四種轉錄狀態:初始細胞 (Tn)、早期活化細胞 (Tearly_act)、活化細胞 (Tact) 及增殖細胞 (Tprolif)。偽時間分析結果進一步確認,CD4+ T 細胞的分化路徑符合預期,即 Tn → Tearly_act → Tact → Tprolif。分析結果還顯示,PC-T2D 患者的 CD4+ T 細胞在活化過程中表現出顯著的代謝異常,包括脂質合成 (lipid anabolism) 相關基因上調,脂質分解 (lipid catabolism)、粒線體功能與細胞氧化還原平衡 (redox homeostasis) 相關基因下調,精準描繪了糖尿病免疫失衡的細胞代謝再程式化 (reprogramming)。
本篇文獻共收集 57 份人類樣本,其中包括健康對照組 (HC) 17 人、WC-T2D 患者 17 人及PC-T2D 患者 23 人。透過 單細胞定序,研究成功捕捉到 HC 與 T2D 患者 CD4+ T 細胞在活化過程中的代謝變化。此文獻作為多樣本臨床研究的典範,充分展現了 10x Single Cell Gene Expression Flex 在檢體儲存與混合樣本上機方面的卓越優勢,為未來糖尿病免疫研究提供了強大的工具與新的視角。
立即了解圖爾思專業服務>> 10x Genomics Single Cell Gene Expression Flex 單細胞定序服務
資料來源
Hyperglycemia-triggered lipid peroxidation destabilizes STAT4 and impairs anti-viral Th1 responses in type 2 diabetes
Cell Metab . 2024 Dec 3;36(12):2511-2527.e7. doi: 10.1016/j.cmet.2024.10.004.



