12
2025.11
精準醫療新維度:ABO基因如何「編輯」腸道微生物的基因體 (SVs)?

你的 ABO 血型,不只決定了輸血,更可能正在決定你的腸道健康!
人類與腸道微生物之間的共生關係,長期以來一直是生命科學與醫學領域的重要議題。但大多研究停留在宿主基因如何影響「腸道菌相的多樣性與豐度」。然而,這項突破性研究深入追問:我們的基因(例如 ABO 血型),是否能進一步「影響」腸道微生物的基因體,甚至改變它們的「功能」?
透過荷蘭大型世代研究的 GWAS 分析與總體基因體 (Metagenome) 定序,這篇文獻揭示了一個驚人機制:宿主的 ABO 血型與 FUT2 基因,會顯著影響關鍵益菌 Faecalibacterium prausnitzii 的基因體結構變異 (SVs),進而決定它們能否利用宿主分泌的醣類(A抗原)。
這項發現證實了,未來的精準醫療不該只看菌種,更要看微生物的「功能基因體」。以下是這篇重磅研究的深度解析。
本研究採用的體學或高通量分析方法包括:
•Shotgun metagenomic sequencing
•Human SNP genotyping / Genome-wide association study (GWAS)
•Microbial structural variation (SV) detection (SGV-Finder)
•Whole-genome sequencing (of bacterial strains) (細菌菌株全基因體定序)
•Gene expression analysis (using qPCR)
•Protein family search and profiling (using shortBRED)
本研究納入 9,015 位來自荷蘭四個大型世代研究 (cohorts) 的受試者,並整合分析他們的腸道總體基因體 (metagenome) 與宿主基因型資料。此外,研究團隊也納入 279 位坦尚尼亞的個案作為驗證群體,以確認宿主基因與菌相間的關聯性,是否能普遍存在於不同遺傳背景及生活方式的族群之中。

微生物SV檢測
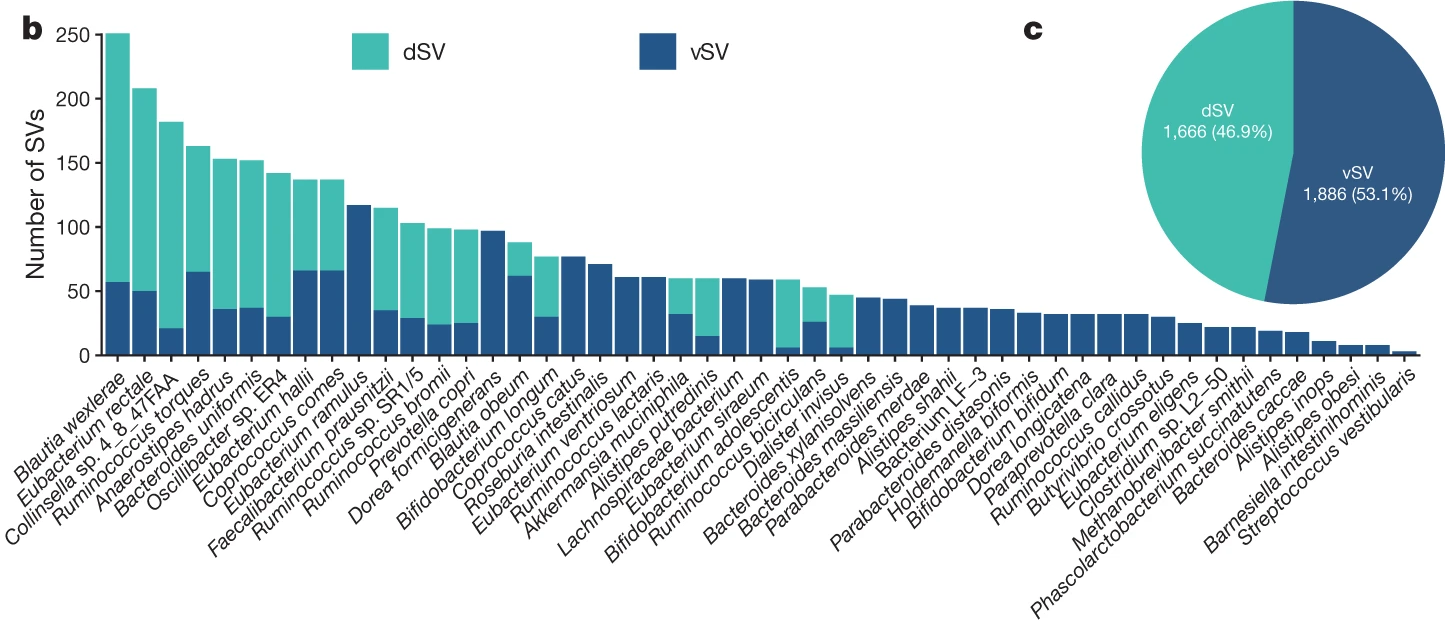
研究團隊首先利用 Shotgun metagenomic sequencing 結合 SGV-Finder 工具,從108種腸道微生物中偵測到 14,196 個 SV。為確保與宿主遺傳關聯的統計效力,團隊進一步篩選出3,552個來自49個菌種的SV,用於後續的全基因體關聯分析 (GWAS)。
這些SV包括刪除型 (dSVs) 與豐度變異型 (vSVs),指的是細菌基因體內可被部分或全部個體攜帶、且在群體間高度變異的基因區段。
微生物SV的遺傳分析
為了評估宿主基因對微生物SV的遺傳貢獻,研究中利用 DMP cohort 中 1,092 對一級或二級親屬,分析了 1,339 個 SV 的家族遺傳性。
結果顯示,在校正菌種豐度後,Faecalibacterium prausnitzii 中一個 dSV (577–579 kb) 具有顯著遺傳率 (h² = 0.38);另有26個 dSVs 和 51 個 vSVs 亦呈現中等遺傳率 (P < 0.05),其平均 h² 分別為 0.28 和 0.41。
這項結果證實,宿主基因對微生物 SV 層級的遺傳調控具有額外的影響力,此一調控機制與單純的物種豐度遺傳率有所不同。
宿主基因型與微生物SV的GWAS分析
接下來,研究團隊將3,552個SV與超過600萬個 SNPs 作了關聯性分析。
在GWAS分析中,最顯著的發現集中於人類 ABO 基因座 (locus) 與 F. prausnitzii SVs 之間的關聯。ABO 基因編碼 (encode) 一種醣基轉移酶,此酵素負責決定人類的 ABO 血型。
因此,研究團隊進一步探討,ABO SNP 與 F. prausnitzii SVs 之間的關聯,是否也代表了宿主 ABO 血型與該 SV 之間的直接關聯。
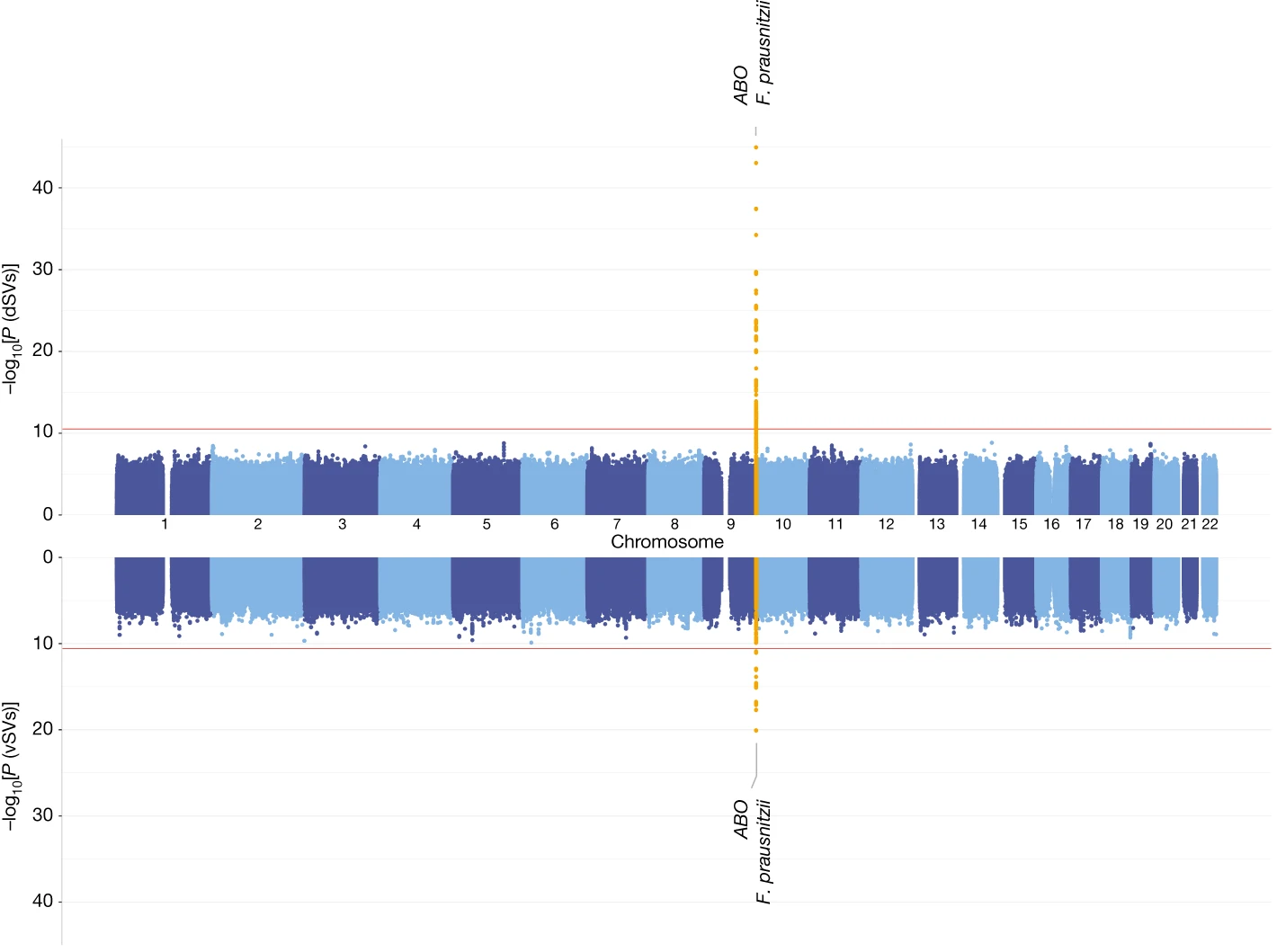
與ABO相關的F. prausnitzii SVs都與宿主的ABO血型相關,且這種關聯也與FUT2分泌狀態有關
分析顯示,Faecalibacterium prausnitzii 的 577–579 kb dSV 區域,在血型為 A 或 AB 的個體中,其出現頻率顯著高於血型為 B 或 O 的個體。
考量到 FUT2 基因決定了宿主是否為「分泌型」(Secretor)——亦即是否將 A 或 B 抗原的前驅物分泌至體液與腸道黏液中——研究團隊在區分這兩類群體後發現:在 FUT2 分泌型的個體中,A 抗原的存在與 F. prausnitzii 577–579 dSV 呈顯著關聯;反之,在非分泌型的個體中,則未觀察到此關聯性。
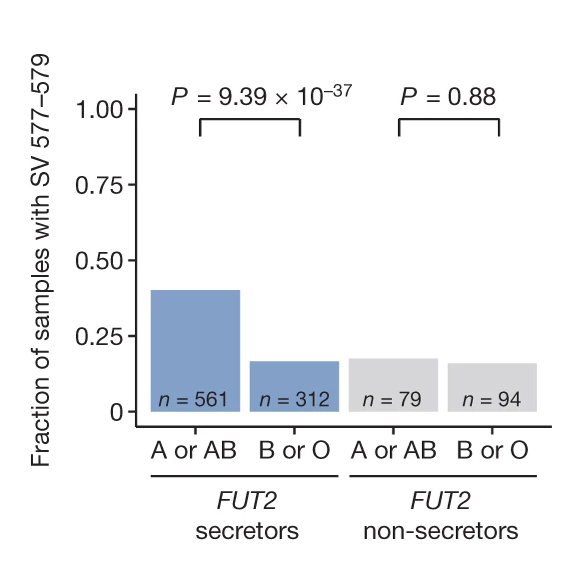
細菌生長實驗驗證GalNAc利用能力
由於 A 抗原是分泌到腸道黏液中的寡糖,可作為細菌的潛在碳源。研究團隊深入分析 Faecalibacterium prausnitzii 577–579 kb dSV 區域後發現,其利用A抗原釋放糖分的能力,與一個 GalNAc (N-乙醯半乳糖胺) 代謝途徑的基因簇密切相關。
進一步的功能分析證實,這個 SV 區段確實包含一組完整的 GalNAc 代謝基因,其中包括能從 A 抗原上切割 GalNAc 的糖苷水解酶 (GH109),以及多個參與下游 GalNAc 利用的關鍵酵素。
體外培養實驗證實,僅有攜帶此 GalNAc 代謝基因簇的 F. prausnitzii 菌株,才能以 GalNAc 作為唯一碳源生長;反之,缺乏該基因簇的菌株則無法利用 GalNAc。
研究更發現,即使菌株擁有此基因簇,一旦該區段在基因體中發生倒位 (inversion),便會導致 GalNAc 吸收相關基因的表現失調,使菌株同樣失去利用 GalNAc 的能力。
GalNAc基因豐度與宿主健康及微生物多樣性的關聯
由於 ABO 基因座亦與其他細菌分類群的豐度相關,研究團隊進一步探討,GalNAc 途徑的存在是否能解釋這些關聯。
分析發現,約有 80% 的 Collinsella aerofaciens 與 23% 的 Faecalibacterium prausnitzii 菌株攜帶完整的 GalNAc 途徑,且實驗證實 C. aerofaciens 同樣能利用 GalNAc 生長。反之,在 Bifidobacterium bifidum 等菌種中則未發現此完整的代謝基因,凸顯了不同菌種間的功能多樣性。

研究團隊進一步利用 (shortBRED) 評估了整體腸道菌相中 GalNAc 基因的總豐度。結果發現,此基因總豐度在具備黏膜 A 抗原(A/AB 血型且為 FUT2 分泌型)的個體中顯著較高;並且,該豐度也與腸道菌相的多樣性、豐富度及多項健康指標(如血糖、糞便型態、整體健康狀態)呈顯著相關。
重要的是,這些關聯性在不具黏膜 A 抗原的個體中則顯著減弱。此一結果進一步證實了宿主基因、微生物功能基因體、乃至宿主健康三者之間,存在著環環相扣的緊密連結。
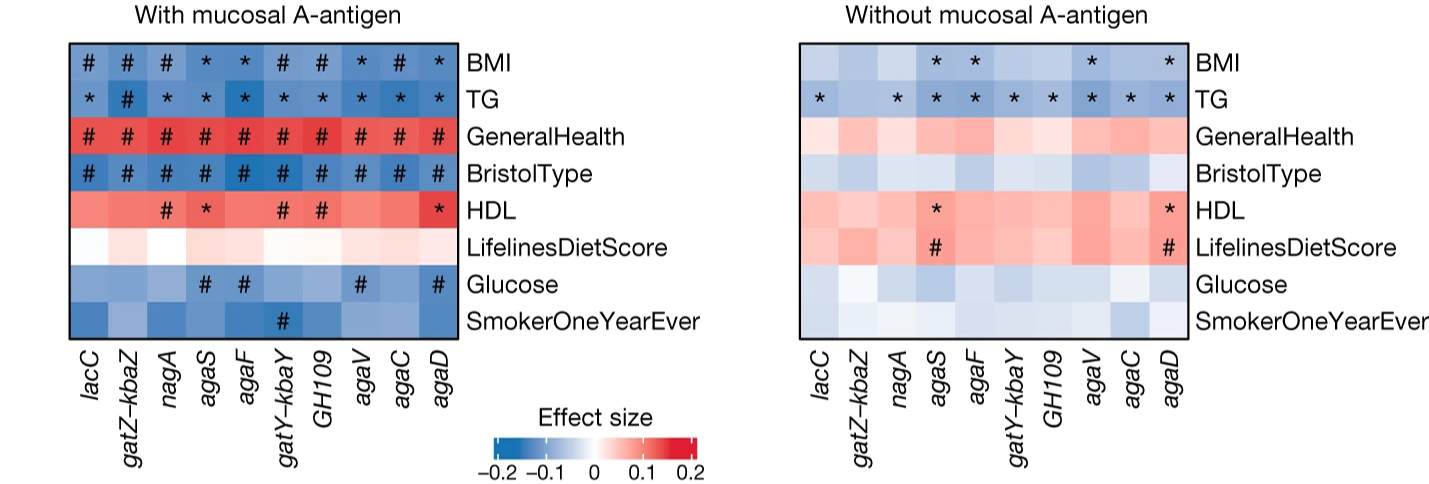
總結來說,本研究證明了人類 ABO 血型基因,特別是在 FUT2 分泌型個體中,能顯著影響腸道微生物基因體的結構變異,進而調控菌相對宿主分泌醣類的利用能力。
這項發現不僅解釋了過去 ABO 血型與特定菌種豐度關聯的現象,更揭示了一個新機制:ABO 血型能透過調控腸道微生物的功能,進而影響人類健康。
本研究也強調,微生物的「功能基因體」(而非單純的「物種豐度」),才是宿主-微生物關聯研究的關鍵切入點,為未來的精準醫療與腸道菌相治療策略,提供了嶄新的科學基礎。
文獻連結
Zhernakova, D.V., Wang, D., Liu, L. et al. Host genetic regulation of human gut microbial structural variation. Nature 625, 813–821 (2024). https://doi.org/10.1038/s41586-023-06893-w



